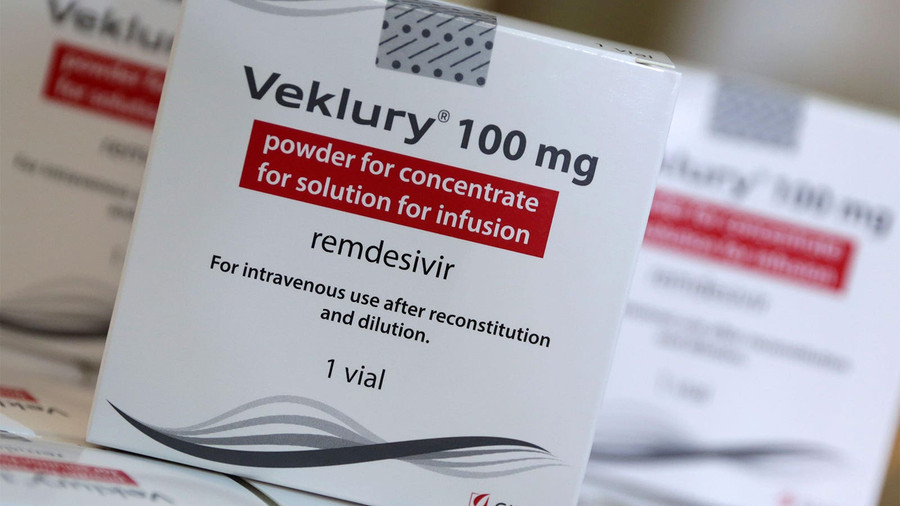
Theo đó, thuốc điều trị Covid-19 Veklury (remdesivir) của Gilead được phê duyệt sử dụng cho bệnh nhi từ 28 ngày tuổi trở lên nặng ít nhất 3 kg (khoảng 7 pound) có kết quả dương tính với virus SARS-CoV- 2 phải nhập viện; hoặc không nhập viện và mắc Covid-19 từ nhẹ đến trung bình và bệnh có nguy cơ cao tiến triển nặng, bao gồm cả nhập viện hoặc tử vong.
Như vậy, thuốc kháng virus Veklury đã trở thành phương pháp điều trị Covid-19 đầu tiên được chấp thuận cho trẻ em dưới 12 tuổi. Với việc phê duyệt này, Cơ quan Quản lý thực phẩm và dược phẩm (FDA) Mỹ cũng đã thu hồi giấy phép sử dụng khẩn cấp đối với Veklury được cấp trước đây để sử dụng cho cả đối tượng trẻ em này.
Trước đây, Veklury chỉ được chấp thuận để điều trị cho một số bệnh nhân mắc Covid-19 trưởng thành và trẻ em (từ 12 tuổi trở lên nặng ít nhất 40 kg, tức khoảng 88 pound).
Bà Patrizia Cavazzoni, Giám đốc Trung tâm Nghiên cứu và đánh giá Thuốc của FDA, cho biết: "Vì Covid-19 có thể gây bệnh nặng ở trẻ em, một số trẻ hiện không có lựa chọn tiêm chủng, nên vẫn cần có các phương pháp điều trị Covid-19 an toàn và hiệu quả cho nhóm đối tượng này. Việc phê chuẩn thuốc điều trị Covid-19 đầu tiên cho nhóm tuổi này hôm nay thể hiện cam kết của FDA đối với nhu cầu đó".
Veklury không thể thay thế cho việc tiêm vắc xin Covid-19 ở những người được khuyến cáo đủ điều kiện tiêm các liều cơ bản và những mũi tiêm nhắc lại. FDA đã chấp thuận hai loại vắc xin và ba loại vắc xin có sẵn để sử dụng trong trường hợp khẩn cấp, qua đó ngăn ngừa Covid-19 và các triệu chứng lâm sàng nghiêm trọng liên quan đến Covid-19, bao gồm cả nhập viện và tử vong. FDA khuyến cáo người dân nên tiêm vắc xin và tiêm nhắc lại khi đủ điều kiện. Việc tìm hiểu thêm về vắc xin Covid-19 được FDA chấp thuận và cho phép.
Việc phê duyệt sử dụng thuốc Veklury ở một số bệnh nhi được căn cứ theo kết quả các thử nghiệm lâm sàng giai đoạn 3 ở người lớn. Thông tin về các thử nghiệm ở người lớn có thể được tìm thấy trong nhãn thuốc được FDA chấp thuận cho Veklury.
Việc chấp thuận này cũng được hỗ trợ bởi một nghiên cứu lâm sàng giai đoạn 2/3 trên 53 bệnh nhi từ tối thiểu 28 ngày tuổi và cân nặng ít nhất 3 kg (khoảng 7 pound) đã được xác nhận nhiễm virus SARS-CoV-2 và mắc Covid-19 thể nhẹ, vừa hoặc nặng.
Bệnh nhân trong giai đoạn 2/3 thử nghiệm nhi khoa này được dùng Veklury trong tối đa 10 ngày. Hiệu quả an toàn và tác động dược động học từ nghiên cứu giai đoạn 2/3 ở đối tượng trẻ em tương tự như ở người lớn.
Dạng bào chế duy nhất của Veklury được chấp thuận là để tiêm.
Các tác dụng phụ có thể xảy ra khi sử dụng Veklury bao gồm tăng nồng độ men gan, có thể là dấu hiệu của tổn thương gan; và các phản ứng dị ứng, có thể bao gồm thay đổi huyết áp và nhịp tim, mức oxy trong máu thấp, sốt, khó thở, thở khò khè, sưng tấy (ví dụ: môi, quanh mắt, dưới da), phát ban, buồn nôn, đổ mồ hôi hoặc rùng mình.