Thuốc phải được cơ quan chức năng cấp phép trước khi lưu hành
Như Báo Giáo dục và Thời đại đã phản ánh, trên thị trường hiện nay xuất hiện loại sản phẩm gọi là thuốc cao vị nhân dạng cao. Nó được quảng cáo là dùng để chữa u xơ, u nang... được tiếp thị trên YouTube, Google, Facebook... Đã có ý kiến bày tỏ nghi ngờ đây là loại thuốc tự phong.
Nhiều video chia sẻ của bệnh nhân, bác sĩ, thương hiệu của tổ chức ý tế cũng được sử dụng trái quy định của Nhà nước về lĩnh vực Dược. Tuy nhiên, việc này vẫn chưa được cơ quan chức năng kiểm tra, làm rõ.
Theo PGS.TS Nguyễn Thế Thịnh, Cục trưởng Cục Quản lý Y Dược Cổ truyền - Bộ Y tế, các sản phẩm thuốc lưu hành toàn quốc phải được cơ quan chức năng cấp phép lưu hành. Đối với thuốc chiết xuất từ dược liệu sẽ do Cục quản lý Dược cấp phép.
Đối với thuốc có nguồn gốc cổ truyền (thuốc gia truyền) sẽ do Cục quản lý Y, Dược Cổ truyền cấp phép. Thực phẩm thì do Cục An toàn thực phẩm cấp phép. Dù thế nào thì các tổ chức phải tuân thủ quy định pháp luật về lĩnh vực Dược. Phải được cơ quan chức năng cấp phép lưu hành và cấp phép quảng cáo...
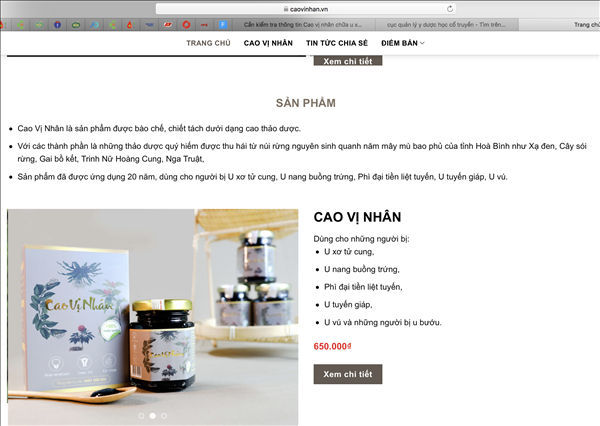
Theo thông tin giới thiệu trên trang caovinhan.vn thì sản phẩm Cao vị nhân được bào chế, chiết tách dưới dạng cao thảo dược với các “thành phần thảo dược quý hiếm được thu hái từ núi rừng nguyên sinh quanh năm mây mù bao phủ của tỉnh Hoà Bình như xạ đen, cây sói rừng, gai bồ kết, trinh nữ hoàng cung, nga truật”.
Trang caovinhan.vn cũng khẳng định loại thuốc dược liệu này đã ứng dụng chữa bệnh u xơ, u nang suốt 20 năm. Tuy nhiên, trang web không công bố các bằng chứng và tài liệu về lịch sử chữa bệnh lâu dài của sản phẩm.
Quy trình cấp phép cho sản phẩm thuốc rất nghiêm ngặt
Theo tìm hiểu của Báo Giáo dục và Thời đại, một sản phẩm muốn được cơ quan chức năng cấp phép lưu hành là thuốc phải trải qua quá trình phức tạp, thậm chí mất rất nhiều năm.
Cụ thể, đối với thuốc có nguồn gốc cổ truyền, trước tiên, đơn vị chịu trách nhiệm sản phẩm phải chứng minh lịch sử sử dụng bài thuốc đó bằng chứng như văn tự, gia phả, tài liệu... Tiếp đến, phải có thoả thuận cho phép sử dụng bài thuốc gia truyền - đối với pháp nhân không cùng dòng họ mua lại bài thuốc gia truyền.
Thoả thuận cho phép sử dụng bài thuốc cổ phương cần phải có xác nhận của tất cả anh, em, họ hàng... những người có liên quan đến bài thuốc. Những tài liệu bước đầu này được tập hợp để xin xác nhận của thôn, xã, huyện, tỉnh.
Xin xác nhận của các cấp địa phương xong, đơn vị chịu trách nhiệm về sản phẩm còn phải tiến hành các bước về thử nghiệm tiền lâm sàng - tức thử nghiệm trên chuột để đánh giá hiệu quả của sản phẩm, tìm ra các độc tính cấp và bán trường diễn nếu có.
Sau khi hoàn thành thử nghiệm tiền lâm sàng thì sản phẩm có thể thử nghiệm lâm sàng - tức thử nghiệm trên cơ thể người. Tuy nhiên, sản phẩm y dược cổ truyền có thể không cần thử nghiệm lâm sàng nếu có đầy đủ bằng chứng về lịch sử sử dụng.
Chưa hết, sản phẩm trước khi được cấp phép là thuốc còn phải trải qua quá trình đánh giá chuyên môn, phản biện từ phía các nhà khoa học và cả cơ quan chức năng.
Theo lãnh đạo một công ty dược trên địa bàn Hà Nội, để ra được giấy phép thuốc công ty mất cả chục năm để chuẩn bị, tập hợp tài liệu chuyên môn thì sản phẩm mới chính thức được cấp phép để lưu hành trên thị trường.
Đối với sản phẩm Cao vị nhân, nhiều người cho rằng, cơ quan chức năng cần sớm vào cuộc kiểm tra việc tuân thủ pháp luật liên quan lĩnh vực dược và đưa ra khuyến nghị để người dân biết và chọn lựa, tránh tình trạng nhập nhèm như hiện nay.