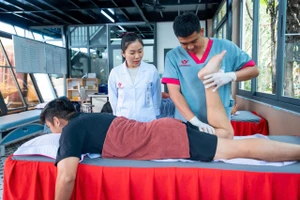
Dự kiến, đầu tháng 6/2021, vắc xin phòng COVID-19 Nano Covax do Học viện Quân y phối hợp với Công ty Nanogen nghiên cứu phát triển sẽ bắt đầu giai đoạn 3 thử nghiệm lâm sàng nhằm đánh giá hiệu lực bảo vệ của vắc xin đối với cộng đồng trước khi cấp phép lưu hành trong tình huống khẩn cấp.
Từ kết quả thử nghiệm giai đoạn 2, dự kiến đầu tháng 6/2021 sẽ bước vào nghiên cứu vắc xin Nano Covax giai đoạn 3 với số lượng tình nguyện viên tham gia dự kiến khoảng 13.000 người.
Học viện Quân y đã huy động đông đảo bác sĩ, kỹ thuật viên, học viên tham gia quá trình thử nghiệm để có thể sẵn sàng triển khai cùng lúc trên 10 tỉnh/thành phố trên cả nước.
Sau khi thử nghiệm giai đoạn 1, giai đoạn 2, vắc xin Nano Covax an toàn nên tiêu chí tuyển tình nguyện viên sẽ nới lỏng hơn 2 giai đoạn trước đó. Tình nguyện viên tham gia giai đoạn 3 từ 18-75 tuổi, chỉ cần kiểm tra công thức máu và kháng thể với virus SARS-CoV-2.
Những người đã phơi nhiễm với virus SARS-CoV-2 hoặc có sẵn kháng thể sẽ bị loại khỏi nhóm đối tượng thử nghiệm.
Giai đoạn 3 nhằm mục đích đánh giá hiệu lực bảo vệ của vắc xin đối với cộng đồng, được thiết kế ở nhiều trung tâm, mở rộng sang các địa phương khác với số lượng mẫu nhiều hơn chỉ với 1 liều tiêm.
Dựa theo kết quả đánh giá, Hội đồng Đạo đức quốc gia trong nghiên cứu y sinh học chọn tiêm thử nghiệm liều 25 mcg.
Sự khác nhau giữa giai đoạn 2 và giai đoạn 2 trong nghiên cứu
Thông tin trên báo chí, GS.TS. Trương Việt Dũng, Chủ tịch Hội đồng Đạo đức quốc gia trong nghiên cứu y sinh học cho biết Hội đồng thông qua kết quả giữa kỳ của giai đoạn 2 nghiên cứu vắc xin Nano Covax. Tuy nhiên những kết quả chính của giai đoạn này gần như đã có; từ đó muốn chuyển sang giai đoạn 3 với tính chất “gối đầu” giai đoạn trước đó.
Đây là phương pháp nghiên cứu vắc xin thiết kế thích ứng mà thế giới cũng đang áp dụng - gọi là thích ứng thiết kế thích, nghĩa là từng giai đoạn 1 có điều chỉnh tùy theo kết quả nghiên cứu và tình hình thực tế.
Do đó, giai đoạn 2 đang thử nghiệm vắc xin Nano Covax nhưng Hội đồng đã xem xét đề cương của giai đoạn 3.
Đề cương nghiên cứu giai đoạn 3 tương tự giai đoạn 2 về kỹ thuật, cách đánh giá... và mở rộng diện nghiên cứu ở các vùng khác nhau.
Ở giai đoạn 2 nghiên cứu “một chứng (những người tiêm giả dược - placebo), 1 vắc xin” nhưng đến giai đoạn 3 sử dụng ít “chứng” hơn để đảm bảo quyền lợi cho tình nguyện viên tham gia nghiên cứu.
Khác với giai đoạn 2 (có 4 nhóm nghiên cứu: 3 nhóm tiêm vắc xin các nhóm liều khác nhau và 1 nhóm tiêm giả dược), giai đoạn 3 sẽ nghiên cứu đơn liều với mức liều thấp nhất 25 mcg nhưng vẫn đủ để sinh kháng thể, sinh miễn dịch.
Số lượng nghiên cứu là “1 chứng, 2 vắc xin”, trong trường hợp cần thiết sẽ chuyển sang “1 chứng, 6 vắc xin” để phù hợp với các điều kiện cụ thể, nhất là diễn biến tình hình dịch bệnh.
Trong giai đoạn 3, đối tượng tiêm thử nghiệm sẽ mở rộng hơn. Đối tượng ở đây có nghĩa là địa bàn, có thể mở rộng đến địa bàn khác như công nhân trong các khu công nghiệp.
Tuy nhiên, những vùng hay khu công nghiệp đang có các ca mắc COVID-19 không được lựa chọn thử nghiệm lâm sàng vì sẽ bị hiểu là do tình hình dịch khiến gười dân đang quá lo lắng và chấp nhận tham gia nghiên cứu.
Do đó, nghiên cứu chỉ có thể thực hiện ở các khu công nghiệp có nguy cơ xuất hiện dịch bệnh, không thực hiện ở những khu công nghiệp đang có dịch. Việc xét nghiệm COVID-19 cho người tham gia thử nghiệm để xác nhận không có kháng thể là điều kiện bắt buộc.
Tính an toàn của tình nguyện viên tham gia nghiên cứu là nhiệm vụ đầu tiên trong nghiên cứu thử nghiệm lâm sàng. Các tình nguyện viên được thông tin trước toàn bộ quyền lợi, trách nhiệm, rủi ro, rơi vào 1 trong 2 nhóm (tiêm vắc xin hoặc giả dược) khi tham gia thử nghiệm và chỉ quyết định tham gia hoặc không sau khi đọc và tìm hiểu kỹ.
Theo GS.TS Trương Việt Dũng, trên tinh thần “thử nghiệm càng nhanh càng tốt” của Chính phủ, Bộ Y tế giao cho các đơn vị thử nghiệm. Nhanh không có nghĩa cắt đoạn, bỏ qua giai đoạn. Bất cứ giai đoạn nào cũng phải tuân thủ yêu cầu, tiêu chuẩn của quốc tế. Làm rất nhanh nhưng phải rất chuẩn, đưa ra Hội đồng phải phê duyệt được ngay.
Theo đúng quy trình và từng bước của mỗi giai đoạn, để Bộ Y tế có đủ cơ sở khoa học để có thể cấp phép khẩn cấp, sử dụng có điều kiện vắc xin Nano Covax ở Việt Nam, chúng ta có thể mất khoảng 2 tháng nữa.